


浙江大学药学院高建青教授、韩旻副教授团队一直致力于在药物/细胞传递领域的关键问题研究,近日分别在Nano Today和ACS Nano杂志在线发表题为“Lactate-driving Pt nanoflower with positive chemotaxis for deep intratumoral penetration”和“Stimulation by exosomes from hypoxia preconditioned human umbilical vein endothelial cells facilitates mesenchymal stem cells angiogenic function for spinal cord repair”的研究论文,分别聚焦乳酸驱动定向趋化性促进纳米制剂的肿瘤渗透,及利用低氧处理血管内皮细胞外泌体调控干细胞促进脊髓组织修复治疗。
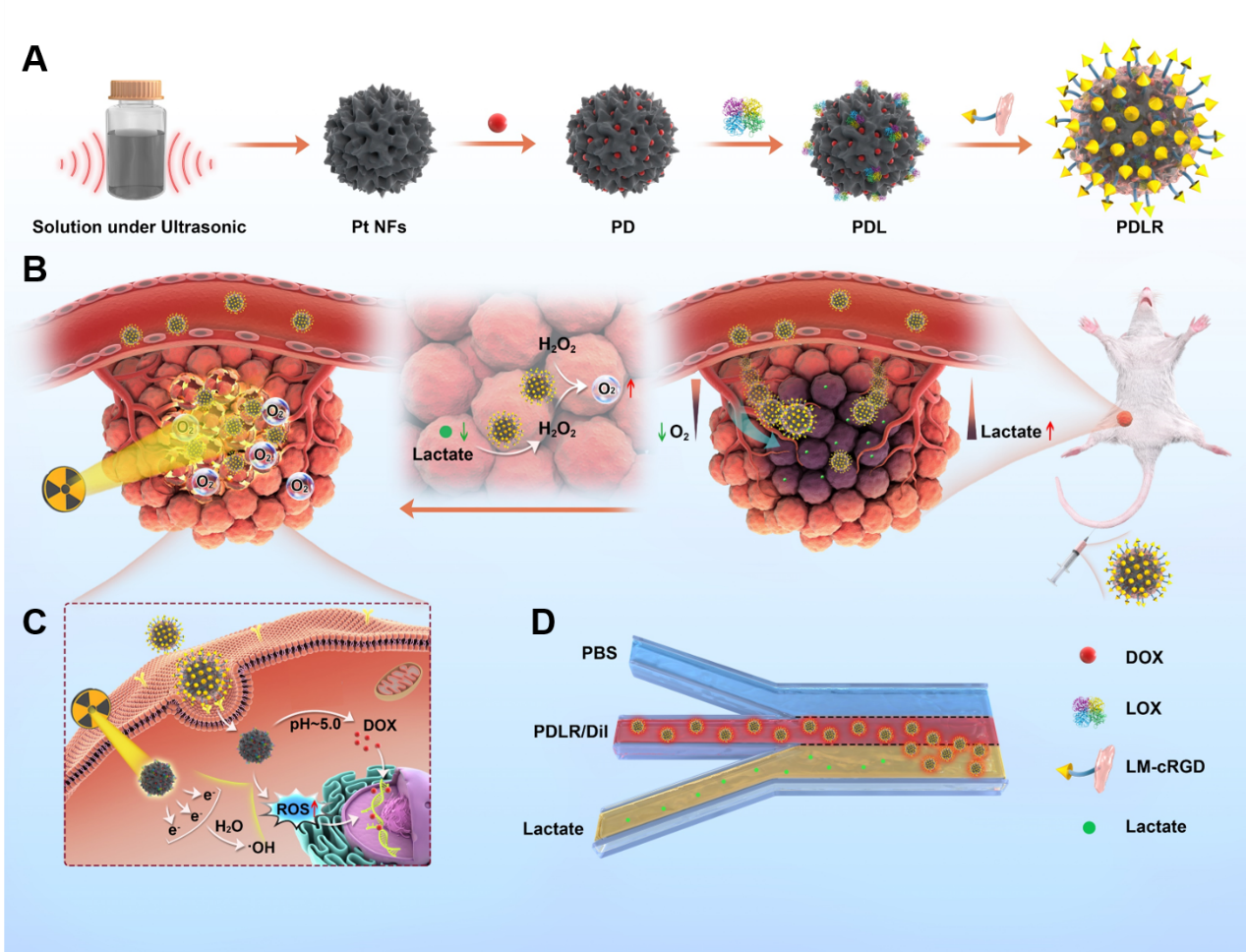
细胞或细胞成分响应特定的化学信号进行定向趋化运动(靠近或远离化学刺激)对于许多生物活动都至关重要,这为研究者们设计“智能型”自主运动纳米马达带来了启发。
基于肿瘤微环境具有高浓度乳酸的特征,研究团队采用乳酸氧化酶(LOX)修饰多功能铂(Pt)纳米粒,构建了一种具有乳酸驱动定向趋化性和级联催化产氧作用的多功能放疗增敏剂,有效促进肿瘤内部小剂量放疗增敏作用,并初步验证了其具有向乳酸溶液侧偏移和肿瘤内部渗透的定向移动行为,为基于肿瘤微环境特性开发酶底物浓度梯度驱动的纳米制剂定向趋化递送和小剂量放疗增敏策略提供借鉴意义,同时也为促进药物肿瘤内部渗透等领域提供新策略。这是继该团队在Nature Communications(2022 May 25;13 (1) : 2906. doi: 10.1038/s41467-022-30634-8)上发表“纳米毯”抑制肿瘤转移前微环境后在抗肿瘤领域的又一进展。该研究论文的第一作者为浙江大学药学院硕士生张振涛和仲海清,通讯作者为浙江大学药学院高建青教授和韩旻副教授。

中枢神经组织修复是当今医学的一大难题,脊髓损伤等中枢神经系统疾病目前尚缺少有效的治疗手段,而血管生成是组织修复过程中的重要和首要环节。干细胞疗法在组织修复中显示了良好的前景,其中,多方面的证据显示间充质干细胞(MSC)可通过对微环境中的信息进行响应和反馈从而调节损伤组织微环境并最终促进组织修复。但实际应用中,血管内皮细胞来源受限且易产生体内免疫排异反应。
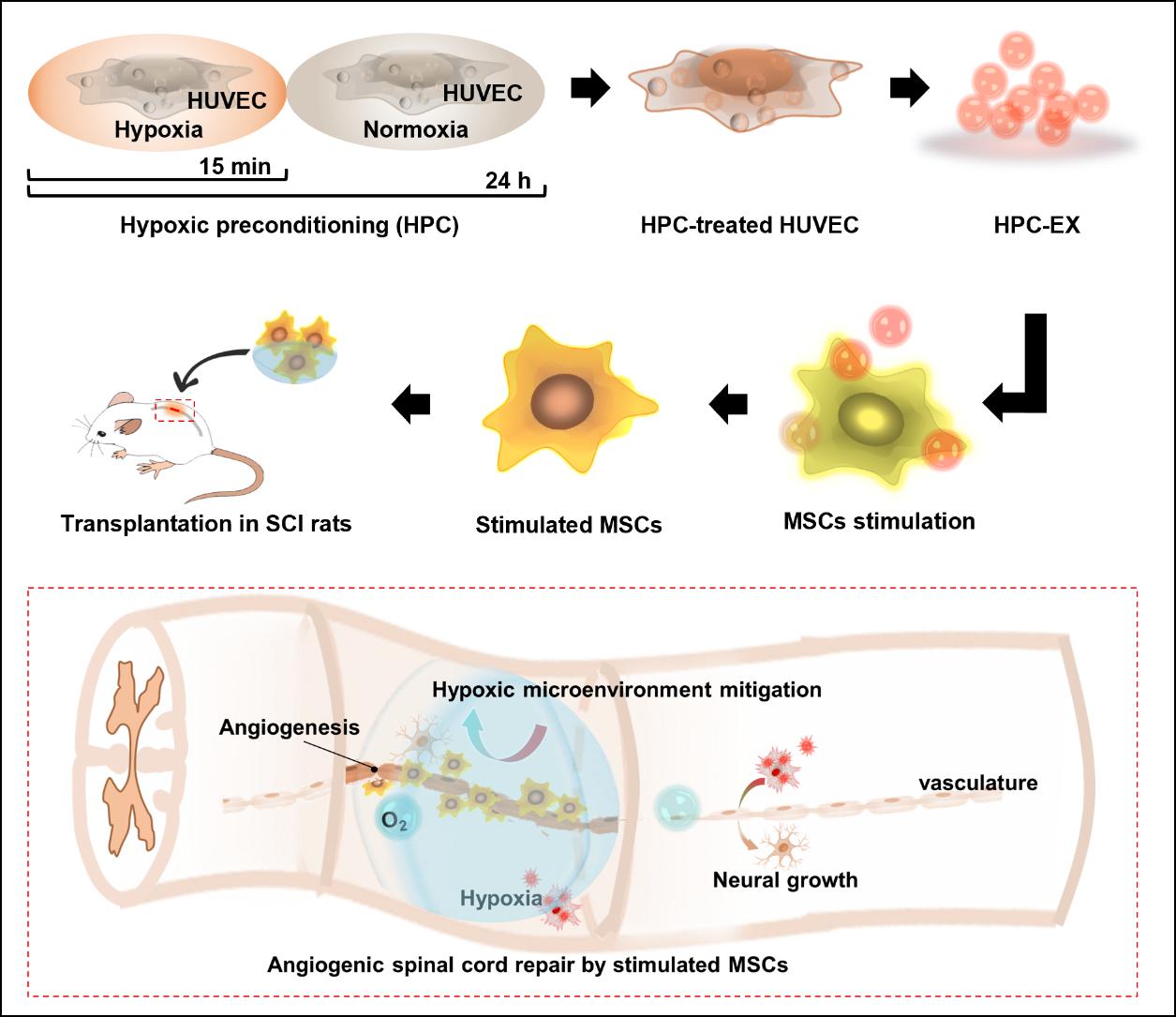
研究团队针对脊髓损伤的缺血微环境和成血管修复治疗,基于细胞外泌体在细胞-细胞交流与细胞-微环境交流中的作用,对人脐静脉血管内皮细胞(HUVEC)进行低氧预适应(HPC)刺激并获取其外泌体(HPC-EX),进一步利用该外泌体调控MSC细胞成血管并进行脊髓损伤治疗。在低氧-常氧的HPC刺激中,时长仅15分钟的低氧刺激即可使HUVEC产生有效促进MSC成血管的HPC-EX,摄取HPC-EX的MSC可在2小时内于基质胶中显著成管,并在植入损伤脊髓组织后促进组织中血管生成和改善炎症微环境,有效促进了组织的修复和神经功能恢复。该项研究为脊髓损伤组织修复治疗提供了高效的促血管生成治疗策略,同时也为基于外泌体和干细胞的疾病治疗提供了新的启发。该研究工作得到天津医科大学总院骨科冯世庆教授和浙江大学医学院附属第一医院骨科蔡友治教授的帮助。论文的第一作者为浙江大学药学院博士后李黎明和博士生母佳富,通讯作者为浙江大学药学院高建青教授和韩旻副教授,该研究受到科技部重点研发计划“人脐带间充质干细胞修复脊髓损伤的临床研究”的资助。
