


线粒体是真核细胞内的重要“能量工厂”,其在很大程度上决定了细胞的命运。近年来的一些研究显示,许多疾病的发生或发展都与细胞内的线粒体受损,引起细胞生理功能紊乱有关。因此,通过将外源性健康线粒体导入受损细胞,来迅速恢复受损细胞胞内的正常能量代谢,维持胞内活性氧(Reactive oxygen species,ROS)稳态,进而缓减甚至阻止疾病发展的线粒体替代治疗被认为是一种极具前景的新型治疗策略。然而,线粒体离开细胞后较短的生存期以及缺乏对受损细胞的靶向能力都限制了这一治疗策略在实际治疗中的应用。
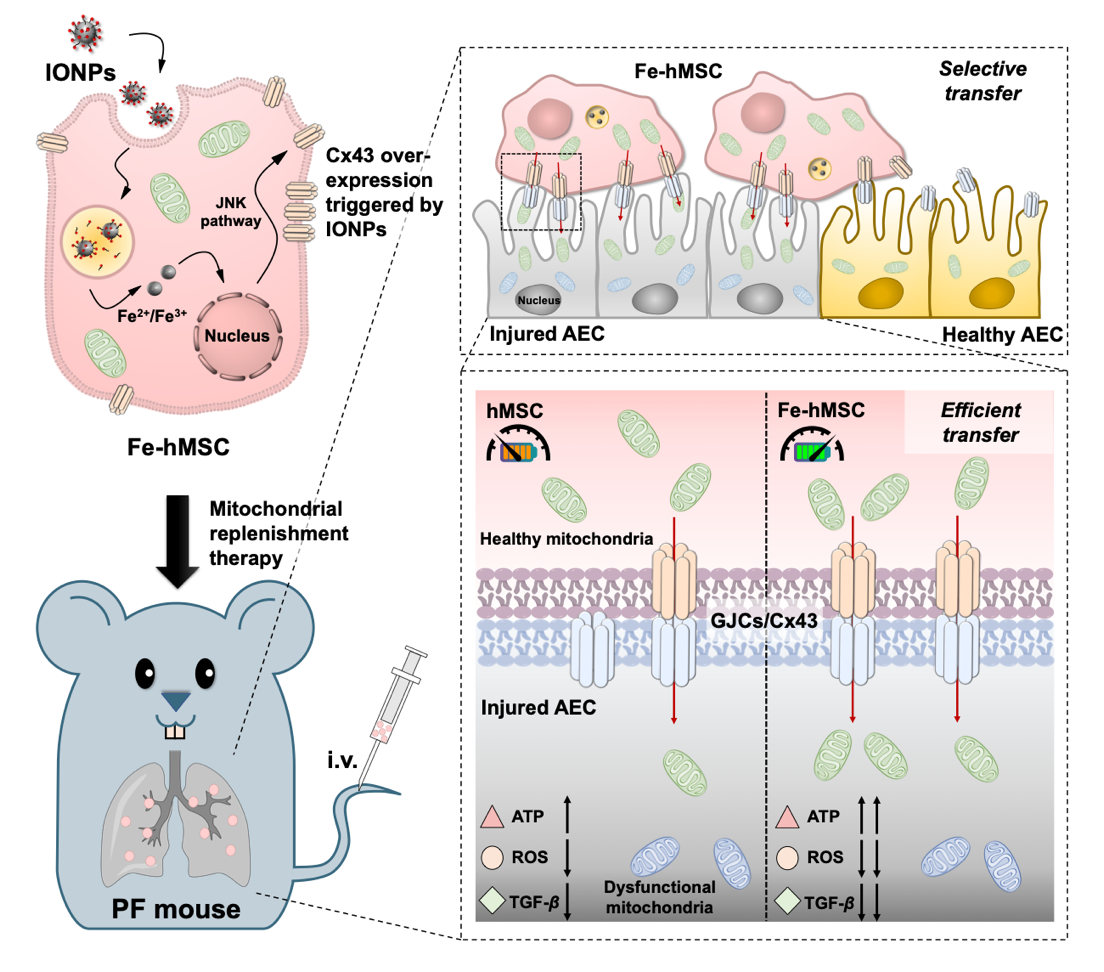
2021年9月29日,浙江大学药学院高建青教授团队在Science Advances杂志发表文章Iron oxide nanoparticles augment the intercellular mitochondrial transfer-mediated therapy,报道了一种通过氧化铁纳米粒(Iron oxide nanoparticles, IONPs)刺激来促进间充质干细胞(Mesenchymal stem cell, MSC)与受损细胞间的间隙连接通道形成(Gap junction channels, GJCs),进而有效提高干细胞的健康线粒体向受损细胞的靶向转运,为实现体内对受损细胞的线粒体替换治疗提供了一种潜在的线粒体递送策略。该文章为当期在线特别推荐文章(Online featured article)。

MSC是存在于人体内的一类成体干细胞,其具有较低的免疫原性和向疾病组织进行归巢的特性。因此,许多研究着开始尝试利用MSC构建“活细胞载体”系统,用于治疗药物在体内向受损组织的靶向递送。高建青教授团队长期从事干细胞载体及干细胞制剂的相关研究,近年来在国家科技部干细胞临床转化重点研发计划、国家自然科学基金国际合作重点项目、面上项目等的持续资助下,在J Control Release,Adv Mater,Adv Funct Mater,ACS Nano和Nano Lett等期刊上连续报道了利用干细胞构建细胞载体靶向递送系统实现多种疾病的靶向治疗。在本研究中,团队成员进一步拓展了干细胞载体系统的应用范围,利用MSC对受损组织的良好归巢特性以及MSC在静息状态时较低的能量需求使得其易于向急需能量供应的损伤细胞传递健康线粒体的特性,构建了基于干细胞载体的线粒体靶向递送系统。同时,研究团队进一步采用IONPs在一定条件下刺激MSC过表达间隙连接通道蛋白43(Connexin 43, Cx43),成功地显著提高了MSC向受损细胞通过GJCs的线粒体转运效率,使得IONPs改良后的MSC可以快速恢复受损细胞的线粒体功能,实现保护和修复受损细胞的治疗目的。通过这一新型传递策略,既可以实现针对受损细胞的高效线粒体靶向传递,又可以保证传递过程中线粒体的稳定性和活性。同时,采用活细胞载体还可以巧妙地规避当前线粒体在提取和纯化过程中面临的失活难题。

为了证实IONPs改良后的MSC可以成为一种潜在的线粒体靶向递送载体用于相关疾病的治疗,团队成员进一步考察了IONPs改良后的MSC对于博来霉素诱导的纤维化小鼠模型的干预治疗作用。肺纤维化是一种导致肺功能进行性丧失的严重间质性肺部疾病,是我国乃至世界范围内主要的难治性疾病之一。相关报道表明肺纤维化同时也是重症新型冠状病毒(Coronavirus disease 2019,COVID-19)感染患者的主要潜在后遗症之一。团队研究结果显示,经IONPs改良的MSC系统注射后可以高效地将健康线粒体选择性递送至博来霉素诱导受损的小鼠肺上皮细胞,且相比使用天然的MSC或者直接给予游离线粒体治疗,都能更有效地延缓纤维化病程的发展,显示了这一策略用于由于线粒体损伤引起的疾病治疗的良好前景。相关研究也为体内针对受损细胞的高效靶向线粒体转运提供了一种可行的解决方案。团队目前正针对本设计理念在大动物模型的治疗效果开展研究。
浙江大学药学院博士研究生黄婷和博士后张添源为本文共同第一作者。高建青教授、顾臻教授和张添源博士为本文共同通讯作者。浙江大学王金强研究员、曹红翠教授,上海交通大学凌代舜研究员、京都大学Yasuhiko Tabata教授等参与了本研究的部分工作。本论文工作受到国家自然科学基金国际合作重点项目及面上项目、中国博士后科学基金、浙江省“万人计划”以及中央高校基本科研业务费专项资金资助。
原文链接:https://www.science.org/doi/10.1126/sciadv.abj0534