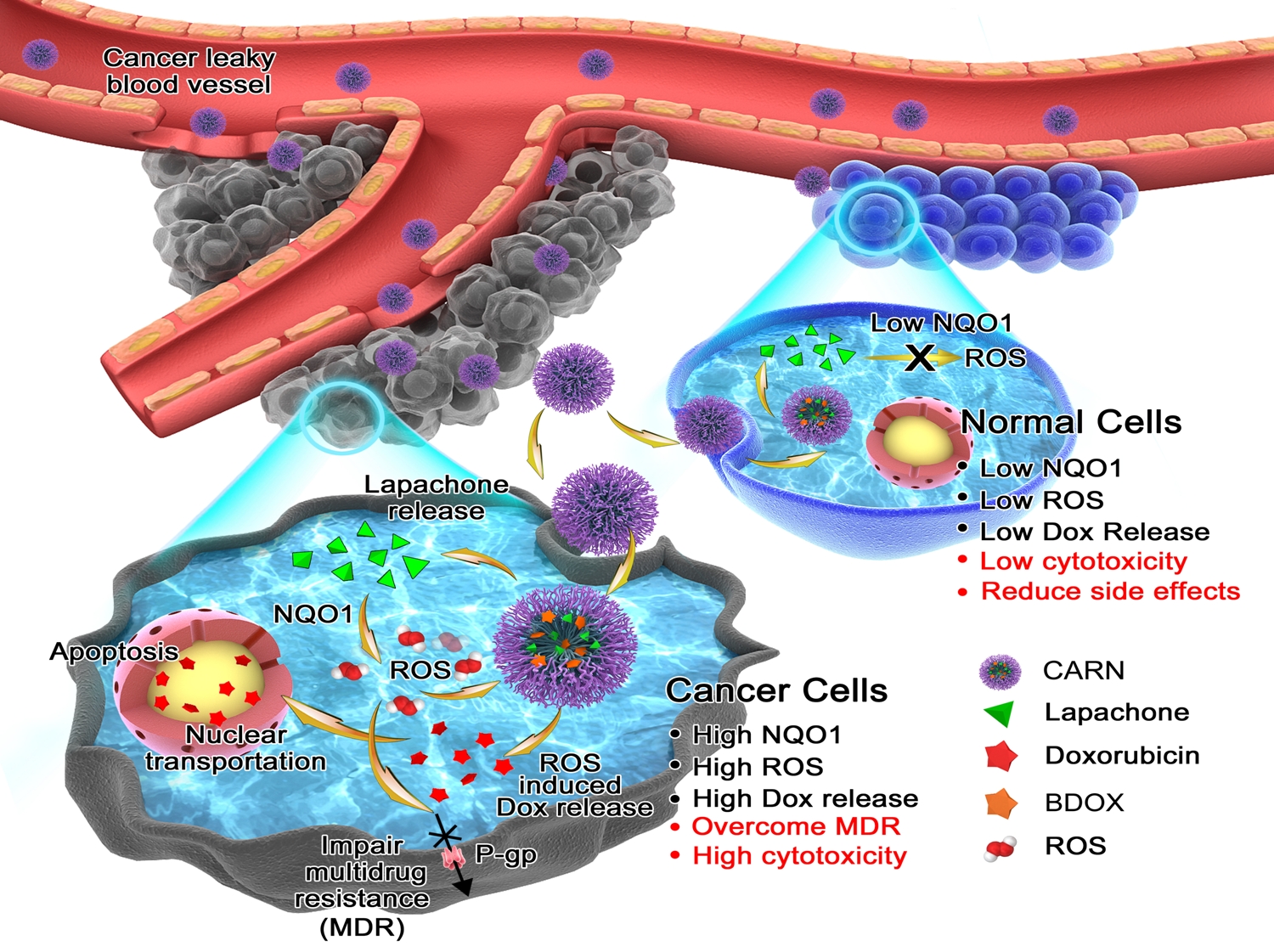
8月21日,浙江大学药物制剂研究所叶明舟博士后为第一作者的工作“A tumor-specific cascade amplification drug release nanoparticle for overcoming multidrug resistance in cancers”在国际权威杂志《Advanced Materials》发表。该文报道了一种新型级联放大纳米药物输送系统,能够在肿瘤细胞过表达醌氧化还原酶(NQO1)的作用下实现药物的精准释放,并通过调节细胞内ROS水平抑制肿瘤的多药耐药性,实现了对耐药肿瘤低毒高效地治疗,并为今后智能纳米药物输送系统提供了重要的指导和借鉴。
化疗是人类对抗肿瘤的重要治疗手段,但在杀灭肿瘤细胞的同时其对正常组织器官也具有巨大的毒副作用,并形成选择压力使肿瘤细胞过表达P-糖蛋白等外排泵,产生多药耐药性并最终导致治疗失败。刺激响应型纳米药物输送系统能够利用纳米系统多功能的特性,通过超通透与滞留效应(EPR effect)被动或主动地靶向肿瘤组织,“智能”地识别出肿瘤并选择性地释放药物,增加疗效并降低毒副作用。然而,由于人体环境及肿瘤细胞的复杂性,传统的pH、ROS或GSH等因素响应的药物输送系统选择性和灵敏度常常不足,对正常组织毒性依然较大。为此,本研究利用肿瘤特异性活性氧(ROS)诱导剂拉帕醌,以及ROS响应前药BDox,构成了一种新型级联放大纳米药物输送系统。该系统在血清中保持稳定,并在进入细胞后逐渐释放出拉帕醌。拉帕醌能够在肿瘤细胞内高表达NQO1酶的作用下,通过氧化还原循环反应产生大量的ROS,并反馈回纳米粒子,迅速激活其中的BDox前药,实现药物的级联放大释放过程。与此相对应的是,由于正常细胞中NQO1表达水平较低,该系统释放的拉帕醌不足以产生足量的ROS引发级联放大过程,因而毒性远低于肿瘤细胞。此外,拉帕醌在产生ROS的同时大量消耗细胞内NAD(P)H和ATP,切断了肿瘤外排药物的能量供给,并下调P-糖蛋白等一系列肿瘤耐药性相关蛋白的表达,从而抑制了肿瘤的多药耐药性,进一步协同阿霉素药物进入细胞核发挥作用。该系统在细胞及动物水平上均显示出对正常组织细胞很高的安全性,对耐药株肿瘤细胞有很好的杀伤及抑瘤效果,具有良好的应用前景并为未来纳米载药系统的开发提供了新的思路。
叶明舟博士2015年进站,合作导师为高建青教授和化工系国家优秀青年基金获得者唐建斌教授。本工作在其博士课题的基础上进一步实现学科交叉,进行了深入的克服肿瘤耐药机制研究,该工作还得到了斯坦福大学饶江洪教授的指导。本研究得到国家自然科学基金,国家重点基础研究发展计划,中央高校基本科研专项资金及中国博士后科学基金的资助。
全文链接:http://onlinelibrary.wiley.com/doi/10.1002/adma.201702342/full