


浙江大学药学院曾苏教授科研团队长期从事药物代谢酶和转运体的活性调节机理及其转化药学研究,在多项国家自然科学基金项目资助下,获得了系列创新成果并发表在Biochem Pharmocol,Drug Metab Dispo,Biochim Biophys Acta,Sci Rep,Mol Pharm等杂志上。
该团队首次发现DNA甲基化对肾细胞癌中有机阳离子转运体2(OCT2)表达下降的重要作用,阐明了其调节OCT2表达的机制,回答了“表观遗传因素调节肾癌细胞中药物转运体逆转耐药”这一重要科学问题。研究成果于2016年7月20日以“Epigenetic activation of the drug transporter OCT2 sensitizes renal cell carcinoma to oxaliplatin”(“基于表观遗传的药物转运体OCT2激活增强肾细胞癌对奥沙利铂的敏感性”)为题在《Science Translational Medicine》以长文(Aticle)形式发表(论文链接:/http://stm.sciencemag.org/content/8/348/348ra97.full)。编辑以“Opening a door into cancer cells”(“打开进入癌症细胞的一扇门”)高度评价这项研究。该论文的第一作者为刘彦卿(2013届)和郑小丽(2016届)博士研究生,通讯作者为余露山副教授和曾苏教授。
肾细胞癌在我国泌尿生殖系统肿瘤中占第二位,是起源于肾实质泌尿小管上皮系统的恶性肿瘤。手术治疗是早、中期肾细胞癌的首选方案,但是由于其对大部分化疗药物耐药,晚期转移性肾癌的治疗一直没有好的办法。该团队从“提高摄取型药物转运体的表达与活性,进而增加癌细胞中化疗药物浓度,最终逆转耐药提高疗效”的药物代谢和转运思路出发,通过对数据库和大量临床样本的筛选分析,发现肾细胞癌中药物摄取型转运体OCT2表达显著下降,细胞和组织水平的检测均表明,DNA甲基化在OCT2转录抑制中发挥重要作用。进一步研究发现,启动子区E-box位点处于DNA高甲基化水平,抑制了MYC蛋白与E-box位点结合,从而阻遏MYC招募MLL1写入组蛋白H3K4me3,降低激活信号组蛋白甲基化水平,最终抑制OCT2的基因转录(图1A)。根据该机制,他们设计了DNA甲基转移酶抑制剂地西他滨(DAC)与OCT2底物类抗癌药物奥沙利铂(Oxa)的序贯联合用药方案。荷瘤小鼠给予地西他滨后肾癌组织中OCT2的表达水平明显升高,致使奥沙利铂在肾癌组织中积聚大量增加,从而发挥显著的抑瘤作用(图1B)。此外,他们还发现多药及毒性化合物外排转运蛋白2K(MATE-2K,该转运体可将奥沙利铂排出细胞外)在肾细胞癌中的表达也显著降低,但是地西他滨不能诱导其表达增加,这使得进入肾癌细胞的奥沙利铂不易被其排出体外。而在正常肾细胞中由于OCT2和MATE-2K的表达都较高,进入肾癌细胞的奥沙利铂可以被MATE-2K外排至尿中而不易积聚,使得奥沙利铂对正常肾组织毒性较低(图2)。
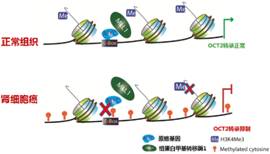
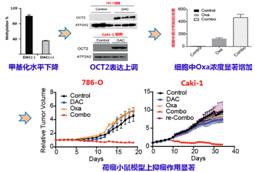
图1. 肾细胞癌中OCT2表达下降的DNA甲基化调节机制(A)及基于该机制设计的联合用药方案(B)
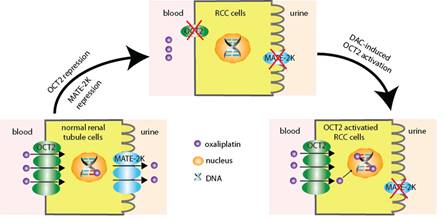
图2. 正常肾细胞和肾癌细胞中OCT2和MATE-2K的表达及对奥沙利铂摄取的影响
该研究以药物转运体为切入点阐明肾细胞癌先天性耐药的表观遗传机制,并获得了全新联合用药方案(中国发明专利2014104173866)。该成果对肾细胞癌的治疗具有积极的意义,同时为其他耐药性肿瘤的治疗提供了思路。